й«ҳдёӯеҢ–еӯҰеҺҹз”өжұ жһ„жҲҗи§Јжһҗ дёӨз§Қй”Ңй“ңеҺҹз”өжұ зҡ„жҜ”иҫғеҰӮдҪ•иҝӣиЎҢ-зҺҜзҗғеҚіж—¶
жҸҗиө·еҺҹз”өжұ ж•ҷжЎҲпјҲй«ҳдёӯеҢ–еӯҰеҺҹз”өжұ жһ„жҲҗпјү еӨ§е®¶еңЁзҶҹжӮүдёҚиҝҮдәҶпјҢиў«и¶ҠжқҘи¶ҠеӨҡзҡ„дәәжүҖзҶҹзҹҘпјҢйӮЈдҪ зҹҘйҒ“еҺҹз”өжұ ж•ҷжЎҲпјҲй«ҳдёӯеҢ–еӯҰеҺҹз”өжұ жһ„жҲҗпјү еҗ—пјҹеҝ«е’Ңе°Ҹзј–дёҖиө·еҺ»дәҶи§ЈдёҖдёӢеҗ§пјҒ
еҺҹз”өжұ ж•ҷжЎҲ(й«ҳдёӯеҢ–еӯҰеҺҹз”өжұ зҡ„з»„жҲҗ)
 гҖҗиө„ж–ҷеӣҫгҖ‘
гҖҗиө„ж–ҷеӣҫгҖ‘
дёҖж¬Ўз”өжұ зҡ„з»„жҲҗгҖҒе·ҘдҪңеҺҹзҗҶеҸҠеә”з”Ё
1.еҺҹз”өжұ зҡ„з»„жҲҗжқЎд»¶(1)дёӨдёӘжҙ»жҖ§дёҚеҗҢзҡ„з”өжһҒ(зҮғж–ҷз”өжұ зҡ„дёӨдёӘз”өжһҒеҸҜд»Ҙе…·жңүзӣёеҗҢзҡ„жҙ»жҖ§)(2)иҙҹжһҒеҸ‘з”ҹж°§еҢ–еҸҚеә”пјҢжӯЈжһҒеҸ‘з”ҹиҝҳеҺҹеҸҚеә”гҖӮ(3)еҲ©з”Ёз”өи§Јж¶ІеҪўжҲҗй—ӯеҗҲеӣһи·ҜгҖӮ
(1)з”өжұ зҡ„з”өжһҒеҸҚеә”дёҖе®ҡжҳҜж°§еҢ–еҸҚеә”жҲ–иҝҳеҺҹеҸҚеә”пјҢдҪҶз”өжұ зҡ„жҖ»еҸҚеә”дёҚдёҖе®ҡжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”гҖӮжІүж·ҖеҸҚеә”гҖҒдёӯе’ҢеҸҚеә”зӯүйқһж°§еҢ–иҝҳеҺҹеҸҚеә”д№ҹеҸҜд»Ҙи®ҫи®ЎжҲҗеҺҹз”өжұ пјӣжӯӨеӨ–пјҢиҝҳеҸҜд»ҘеҲ©з”ЁзҰ»еӯҗжө“еәҰе·®жқҘи®ҫи®ЎеҺҹз”өжұ пјҢеҚівҖңжө“е·®з”өжұ вҖқгҖӮ(2)з”өи§ЈиҙЁеҸҜд»ҘжҳҜз”өи§ЈиҙЁзҡ„ж°ҙжә¶ж¶ІгҖҒиғҪеӨҹдј еҜјзҰ»еӯҗзҡ„еӣәдҪ“з”өи§ЈиҙЁжҲ–жңүжңәз”өи§ЈиҙЁжә¶ж¶ІгҖӮ
2.дёӨз§Қй”Ңй“ңеҺҹз”өжұ зҡ„жҜ”иҫғ
a(еҚ•е®Өз”өжұ )B(дәҢе®ӨзӣҗжЎҘз”өжұ )
(1)дёҖе®Өз”өжұ зҡ„зјәзӮ№:е·ҘдҪңдёҖж®өж—¶й—ҙеҗҺпјҢй”ҢзүҮиЎЁйқўи§ӮеҜҹеҲ°е°‘йҮҸзҙ«й“ңпјҢиҜҙжҳҺй”ҢзүҮиЎЁйқўжңүи…җиҡҖз”өжөҒпјҢз”өжұ ж•ҲзҺҮдёҚй«ҳгҖӮеҪ“з”өжұ дёҚе·ҘдҪңж—¶пјҢй”ҢзүҮ继з»ӯиў«ж°§еҢ–пјҢдҪҝз”өжұ зҡ„еӮЁеӯҳж—¶й—ҙеҸҳзҹӯгҖӮ(2)еҸҢе®ӨзӣҗжЎҘз”өжұ зҡ„дјҳзӮ№:еҲ©з”ЁзӣҗжЎҘйҳІжӯўж°§еҢ–еүӮе’ҢиҝҳеҺҹеүӮзӣҙжҺҘжҺҘи§ҰпјҢеҸҜд»ҘжҸҗй«ҳз”өжұ ж•ҲзҺҮпјҢ延й•ҝз”өжұ зҡ„еӮЁеӯҳж—¶й—ҙгҖӮ
еҺҹз”өжұ еҺҹзҗҶзҡ„ж·ұе…ҘеҲҶжһҗ
(1)й“қ-й“ңжө“зЎқй…ёз”өжұ
еңЁеҲқе§Ӣйҳ¶ж®өпјҢжҙ»жҖ§йҮ‘еұһй“қдҪңдёәиҙҹжһҒиў«ж°§еҢ–пјҢй“қиў«й’қеҢ–жҳҜеӣ дёәй“қиЎЁйқўиҝ…йҖҹеҪўжҲҗиҮҙеҜҶзҡ„ж°§еҢ–иҶңпјҢйҳ»жӯўеҸҚеә”继з»ӯиҝӣиЎҢгҖӮжЈҖжөҒи®ЎжҢҮй’ҲеӣһеҲ°0еҗҺпјҢй“ңдҪңдёәиҙҹжһҒпјҢй’қеҢ–й“қдҪңдёәжӯЈжһҒгҖӮжЈҖжөҒи®ЎжҢҮй’Ҳеҗ‘дёҺеҲқе§Ӣйҳ¶ж®өзӣёеҸҚзҡ„ж–№еҗ‘еҒҸиҪ¬гҖӮ
(2)й•Ғй“қзҮғзғ§жІ№жІ№иө„жәҗ *** зўұжҖ§жә¶ж¶Із”өжұ
еҸӢеҸӢиө„жәҗзҪ‘еҲқжңҹпјҢжҙ»жҖ§йҮ‘еұһй•ҒдҪңдёәиҙҹжһҒиў«ж°§еҢ–пјҢз”ҹжҲҗзҡ„ж°ўж°§еҢ–й•Ғйҷ„зқҖеңЁй•Ғз”өжһҒдёҠпјҢйҳ»жӯўеҸҚеә”继з»ӯиҝӣиЎҢпјҢй’қеҢ–й•ҒгҖӮжЈҖжөҒи®ЎжҢҮй’ҲеҪ’йӣ¶еҗҺпјҢй“қдёәиҙҹжһҒпјҢй•ҒдёәжӯЈжһҒпјҢжЈҖжөҒи®ЎжҢҮй’ҲеҒҸиҪ¬ж–№еҗ‘дёҺеҲқе§Ӣйҳ¶ж®өзӣёеҸҚгҖӮ
4.еҺҹз”өжұ еҺҹзҗҶеңЁз”ҹжҙ»дёӯзҡ„еә”з”Ё(1)еҜ№дәҺйҮ‘еұһдҝқжҠӨпјҢе°Ҷиў«дҝқжҠӨзҡ„йҮ‘еұһеҲ¶е“Ғ(еҰӮжө·иҲ№зҡ„иҲ№дҪ“)дҪңдёәеҺҹз”өжұ зҡ„йҳіжһҒ(йҳҙжһҒ)иҝӣиЎҢдҝқжҠӨпјҢе°ҶеөҢеңЁйҮ‘еұһеҲ¶е“ҒиЎЁйқўзҡ„жҙ»жҖ§йҮ‘еұһ(еҰӮй”Ңеқ—)дҪңдёәеҺҹз”өжұ зҡ„йҳҙжһҒ(йҳіжһҒ)иҝӣиЎҢи…җиҡҖпјҢеҚізүәзүІйҳіжһҒзҡ„йҳҙжһҒдҝқжҠӨж–№жі•гҖӮ(2)е°ҶеҸҳй»‘зҡ„银еҷЁжҒўеӨҚеҲ°й“¶еҷЁдёҠж—¶й—ҙй•ҝдәҶпјҢиЎЁйқўдјҡз”ҹжҲҗAg2SпјҢйҖҗжёҗеҸҳй»‘(4Ag+O2+2H2S=2Ag2S+2H2O)гҖӮеңЁй“қе®№еҷЁдёӯеҠ е…Ҙзӣҗжә¶ж¶І(дҪңдёәиҙҹжһҒ)пјҢ然еҗҺе°ҶеҸ‘й»‘зҡ„银еҷЁ(дҪңдёәжӯЈжһҒ)жөёе…Ҙжә¶ж¶ІдёӯгҖӮдёҖж®өж—¶й—ҙеҗҺпјҢй»‘иүІзҡ„Ag2SдјҡиҝҳеҺҹжҲҗ银зҷҪиүІзҡ„е…ғзҙ 银гҖӮиҝҷз§Қж–№жі•еҸҜд»ҘдҪҝеҸҚеә”дёәйҳҙжҖ§:2al-6e-= 2al 3+пјӣйҳіжҖ§еҸҚеә”:3ag 2s+6e-= 6ag+3s 2-пјӣиҙҹжһҒдә§з”ҹзҡ„Al3+е’ҢжӯЈжһҒдә§з”ҹзҡ„S2-еңЁжә¶ж¶Ідёӯ继з»ӯеҸҚеә”:2al 3 ++ 3s 2-+6h2o = 2al(OH)3вҶ“+3H2SвҶ‘гҖӮ
\- еӨ©еӨ©зҹӯи®ҜпјҒWin7зҺ©иӢұйӣ„иҒ”зӣҹжҸҗзӨәвҖңж— жі•иҝһжҺҘеҲ°жңҚеҠЎеҷЁпјҢиҜ·жЈҖжҹҘжӮЁзҡ„зҪ‘з»ңиҝһжҺҘвҖқ еҰӮдҪ•зЎ®и®ӨзҪ‘з»ңиҝһжҺҘжҳҜеҗҰжӯЈеёё
- з”өи„‘жӣҙж”№жөҸи§ҲеҷЁйЎөйқўеӨ§е°Ҹзҡ„ж–№жі• еҸҜд»ҘзӣҙжҺҘйҖүжӢ©100%зҡ„жҜ”дҫӢжҒўеӨҚеҺҹзҠ¶еҗ—
- 笔记жң¬з”өжұ еҰӮдҪ•дҝқе…»пјҹжҝҖжҙ»жҲҙ尔笔记жң¬зҡ„ж–°з”өжұ еҸҜд»Ҙиҝҷд№ҲеҒҡ
- жҝҖжҙ»Win7зі»з»ҹжҸҗзӨәвҖңзі»з»ҹдҝқз•ҷеҲҶеҢәжңӘеҲҶй…Қй©ұеҠЁеҷЁеҸ·вҖқ е°Ҹзј–дёәеӨ§е®¶д»Ӣз»ҚеҰӮдҪ•и§ЈеҶіжӯӨй—®йўҳ|еҝ«ж’ӯ
- е…Ёзҗғеҫ®иө„и®ҜпјҒеҰӮдҪ•з”ЁitunesеӨҮд»ҪжүӢжңә еңЁвҖңжүӢеҠЁеӨҮд»Ҫе’ҢжҒўеӨҚвҖқдёӯжңүе“ӘдәӣйҖүйЎ№еҸҜз”Ё
- Windows10зі»з»ҹжү“дёҚејҖж·ҳе®қзҪ‘йЎөеҰӮдҪ•и§ЈеҶі еҸҜд»Ҙе°қиҜ•йҮҚеҗҜдёӢи·Ҝз”ұеҷЁзӯүж–№жі•
- еҸҜзҲұйҳҝзӢёз”өи„‘дё»йўҳеӨ§йӣҶеҗҲ жғіеҪ“йЈһиЎҢе‘ҳзҡ„йҳҝзӢёе°ҪжҳҫйҖҚйҒҘиҮӘеҫ—
- acer笔记жң¬йҮҚиЈ…зі»з»ҹж•ҷзЁӢ дёҖиҲ¬uefiжЁЎејҸйңҖиҰҒйҮҚиЈ…win10еҗ—
- ж–Ү件еӨ№еӣҫж ҮжҖҺд№Ҳж”№пјҹе°Ҹзј–дёәеӨ§е®¶жҺЁиҚҗдёҖз§Қжӣҙж”№жЎҢйқўеӣҫж Үзҡ„ж–№жі•_зҺҜзҗғеҝ«ж¶ҲжҒҜ
- гҖҠз”ҹеҢ–еҚұжңә4пјҡйҮҚеҲ¶зүҲгҖӢиҖҒйј иүҫд»ҖиҺүзҲҶзҒ« еҚЎжҷ®з©әе®ҳж–№д№ҹејҖе§ӢзҺ©жў—_зҺҜзҗғзңӢзғӯи®Ҝ
- Wi-FiиҒ”зӣҹжҠҘе‘Ҡпјҡз ”з©¶жҳҫзӨәWi-FiжңүеҠ©дәҺиҠӮиғҪеҮҸжҺ’ е…Ёзҗғж–°и§ҶйҮҺ
- и§ӮйҖҹи®ҜдёЁж— зәҝдј иҫ“д»ӢиҙЁжҠ—е№Іжү°жҖ§ејәеҗ—пјҲж— зәҝдј иҫ“д»ӢиҙЁпјү
- е…ЁзҗғзңӢзғӯи®ҜпјҡеҸӢдәәи°ҲеқӮжң¬йҫҷдёҖжңҖеҗҺж—¶еҲ»пјҡд»ҚеңЁе…іеҝғж°”еҖҷзӯүй—®йўҳ
- еӨ©еӨ©йҖҡи®ҜпјҒеҗ‘е…ЁзҗғзІҫиӢұеҸ‘еҮәйӮҖиҜ·вҖңеҘ”еҗ‘и“қжө·вҖқпјҢиұЎеұұеҶҚж¬ЎеҗҜеҠЁиҝҷеңәеӨ§иөӣ
- вҖңдёҡдё»е°ҒиҮӘ家йҳіеҸ°жҲҗиў«е‘ҠвҖқиҝҺжқҘз»Ҳе®Ўпјҡдёҡдё»иҙҘиҜүпјҢжі•йҷўеҲӨеҶіе…¶жӢҶйҷӨйҳіеҸ°е№¶жҒўеӨҚеҺҹзҠ¶
- жңҖиө„и®ҜдёЁ5.75дәҝи¶…гҖҠдҪ зҡ„еҗҚеӯ—гҖӢпјҒгҖҠй“ғиҠҪд№Ӣж—…гҖӢжҲҗдёӯеӣҪеҪұеҸІж—Ҙжң¬еҠЁз”»зҘЁжҲҝ第дёҖ
- е°Ҹзұі13 Ultraе®ҳж–№йў„зғӯпјҡйӣ·еҶӣз–ҜзӢӮжҡ—зӨә
- и¶ҠйӘӮи¶Ҡд№° iPhone 13е…ЁзҗғжңҖз•…й”ҖжүӢжңә
- еҠЁжҖҒз„ҰзӮ№:зү№ж–ҜжӢүдҪҺд»·иҪҰеһӢиҰҒжқҘдәҶ е№ҙдә§иғҪжҲ–иҫҫ400дёҮиҫҶ
- жҠ–йҹіе°Ҹеј еӣ ж•ҷдәәеқҗй«ҳй“ҒзҒ«дәҶпјҡй’ұе’ҢзғҰжҒјд№ҹйғҪжқҘдәҶ иҰҒй—»йҖҹйҖ’
- 4жңҲ04ж—Ҙ13ж—¶еұұдёңдёҙжІӮз–«жғ…йҳІжҺ§жғ…еҶө 4жңҲ04ж—Ҙ13ж—¶еұұдёңдёҙжІӮз–«жғ…жңҖж–°йҖҡзҹҘ
- гҖҠй“ғиҠҪд№Ӣж—…гҖӢзҘЁжҲҝи¶…гҖҠдҪ зҡ„еҗҚеӯ—гҖӢпјҒзӣ®еүҚиұҶз“Ј7.4еҲҶ дё–з•ҢжҠҘиө„и®Ҝ
- еҒҡе°„йў‘зҫҺе®№д»ӘиҖҒеҫ—жӣҙеҝ«зңҹзҡ„еҒҮзҡ„
- жё…жҳҺиҠӮиҜ—еҸҘеҸӨиҜ—з»Ҹе…ёиҜ—иҜҚиҜӯеҪ• жё…жҳҺиҠӮжңӢеҸӢеңҲж–ҮжЎҲиҜҙиҜҙжңҖж–°
- гҖҠе°Ҹдё‘2гҖӢж–°зүҮеңәз…§жӣқе…үпјҡLady GagaеҗҢеҮӨеҮ°еҸ”жҝҖжғ…иЎЁжј”пјҒ
- еҫ®иҪҜ Bing Chat ж·»еҠ еӣҫеғҸе’Ңи§Ҷйў‘жҗңзҙўз»“жһң ж”№иҝӣеҝ…еә”жң¬ең°еҢ–жҗңзҙўдҪ“йӘҢ-еӨ©еӨ©ж¶ҲжҒҜ
- иӢ№жһңз»ҲдәҺд»ҺеҶ…йғЁиЈҒе‘ҳдәҶпјҹж¶ҲжҒҜз§°е°ҶзІҫз®Җйӣ¶е”®еӣўйҳҹйғЁеҲҶиҒҢдҪҚ
- ж·ҳе®қAPPйҰ–йЎөжөӢиҜ•дёҠзәҝ99зү№еҚ–йў‘йҒ“ йў„и®Ў4жңҲдјҡе…ЁйқўдёҠзәҝ
- дё–з•ҢйҖҹи®Ҝпјҡзү©зҗҶеӯҰ家еңЁдёҖдёӘж–°зҡ„з»ҙеәҰдёҠжҸӯзӨәдәҶе…үзҡ„йҮҸеӯҗжҖ§иҙЁ
- 马ж–Ҝе…Ӣе°ҶжҺЁзү№еӣҫж ҮжҚўжҲҗжҹҙзҠ¬ зӢ—зӢ—еёҒд»·ж јеә”еЈ°йЈҷеҚҮи¶…30% зҺҜзҗғзғӯй—»
- й…·зӢ—йҹід№җжҖҺд№Ҳи·іиҝҮжӯҢжӣІеӨҙе°ҫ й…·зӢ—йҹід№җи·іиҝҮзүҮеӨҙеңЁе“Ә еҝ«ж’ӯ
- дәҡиЎҢйў„жөӢпјҡдәҡеӨӘең°еҢәд»ҠжҳҺдёӨе№ҙз»ҸжөҺеўһйҖҹжҲ–иҫҫ4.8%
- 4жңҲ04ж—Ҙ12ж—¶еӣӣе·қйҳҝеққз–«жғ…жңҖж–°йҖҡжҠҘд»ҠеӨ© 4жңҲ04ж—Ҙ12ж—¶еӣӣе·қйҳҝеққд»Ҡж—Ҙж–°еўһжҙ»еҠЁиҪЁиҝ№жңүеҗ—|дё–з•ҢзҷҫдәӢйҖҡ
- е…Ёзҗғи§ӮеҜҹпјҡиҝӘеЈ«е°јгҖҠжө·жҙӢеҘҮзјҳгҖӢе°ҶжӢҚзңҹдәәз”өеҪұпјҒе·ЁзҹіејәжЈ®йҘ°жј”еҚҠзҘһжҜӣдјҠ
- з„ҰзӮ№зғӯи®®:马ж–Ҝе…ӢиҝҷдёӘиӯҰе‘ҠпјҢдёҖе®ҡжІЎз”Ё
- еӨ©еӨ©ж»ҡеҠЁ:еҜјжј”йҷҶе·қпјҡAI 15з§’з”ҹжҲҗзҡ„жө·жҠҘ жҜ”дё“дёҡе…¬еҸёдёҖдёӘжңҲеҒҡеҫ—иҝҳеҘҪ
- 240Hzз”өз«һеұҸпјҹзҺ©е®¶еқҰиЁҖз”ЁOMENжҡ—еҪұзІҫзҒө9еҶҚж— еҚЎйЎҝзғҰжҒј
- еӨ©еӨ©и§ӮеӨ©дёӢпјҒRTX 4060笔记жң¬е”®д»·5899пјҒе°ҶжҳҹжёёжҲҸжң¬жҖ§д»·жҜ”д№ӢзҺӢпјҒ
- зҺҜзҗғж–°иө„и®Ҝпјҡ马ж–Ҝе…Ӣе°ҶжҺЁзү№еӣҫж ҮжҚўжҲҗжҹҙзҠ¬ з§°е…¬еҸёжңӘжқҘеёӮеҖјиҫҫеҲ°2500дәҝзҫҺе…ғ
- иҚЈиҖҖplay7tе’Ңplay7tproе“ӘдёӘеҘҪ еҢәеҲ«еҸӮж•°й…ҚзҪ®д»·ж јеҜ№жҜ”
- д»Ҡж—Ҙзғӯй—»!жӢ…еҝ§жғ…з»Ә蔓延 жҫіеӨ§еҲ©дәҡзҰҒжӯўж”ҝеәңи®ҫеӨҮдҪҝз”ЁTikTok
- и°ғжҹҘжҳҫзӨәвҖӢиӢ№жһңзҡ„"Find My"еҠҹиғҪдёҺAirTagsж—¶еёёиў«з”ЁжқҘиҝҪиёӘй…ҚеҒ¶
- з”өи„‘жҳҜе“ӘдёҖе№ҙеҸ‘жҳҺзҡ„пјҹз”өи„‘жҖҺд№ҲйҮҚиЈ…зі»з»ҹпјҹз”өи„‘жҳҜиӢұж–Үзҡ„жҖҺд№Ҳж”№жҲҗдёӯж–Үпјҹ
- дё–з•Ңж—¶и®Ҝпјҡж¶ҲзҒӯеҲҳжө·жҢ–еӯ”пјҒжӣқiPhone 17 Proе°ҶжҳҜйҰ–ж¬ҫзңҹе…ЁйқўеұҸиӢ№жһңжүӢжңә
- иӢұйӣ„иҒ”зӣҹеӨ§и„ҡжҖҺд№Ҳдҝ®еӨҚжёёжҲҸпјҹиӢұйӣ„иҒ”зӣҹеӨ§и„ҡжҖҺд№Ҳз»‘е®ҡжёёжҲҸиҙҰеҸ·пјҹ
- йҡҸзқҖChatGPTзӯүз”ҹжҲҗејҸAIзҡ„йҮҮз”Ё зҪ‘з»ңй’“йұјйӮ®д»¶ж”»еҮ»еўһй•ҝ135%
- ж‘©жүҳзҪ—жӢүmoto razr 2023йҖҡиҝҮи®ӨиҜҒпјҡ3640mAhз”өжұ гҖҒ33Wеҝ«е…… дё–з•ҢеӨҙжқЎ
- жҳҫеҚЎй•ҝжңҹ80еәҰе®№жҳ“еқҸеҗ—пјҹжҳҫеҚЎй•ҝжңҹ70еәҰе®№жҳ“еқҸеҗ—пјҹжҳҫеҚЎжҖҺд№ҲжӢҶдёӢжқҘпјҹ
- tploginи·Ҝз”ұеҷЁи®ҫзҪ®ж–№жі•жңүе“Әдәӣпјҹи·Ҝз”ұеҷЁз®ЎзҗҶе‘ҳеҜҶз ҒжҳҜеӨҡе°‘пјҹ
- з”өеҺӢдёҚзЁіз”өи„‘жҖ»жҳҜиҮӘеҠЁе…іжңәжҖҺд№ҲеҠһпјҹз”өи„‘з”өжәҗдёҚзЁіе®ҡдјҡеҜјиҮҙд»Җд№Ҳй—®йўҳпјҹ
- жҜҸж—Ҙзҹӯи®ҜпјҡеҒҘе…ЁвҖңжё…еҚ•вҖқжһ„е»әдәІжё…ж”ҝе•Ҷе…ізі»
- и…ҫи®Ҝдјҡи®®и°ғж•ҙд»Ҡж—Ҙз”ҹж•Ҳпјҡ"300дәәдёҚйҷҗж—¶дјҡи®®"ејҖе§Ӣ收иҙ№
- еӨ©еӨ©ж–°иө„и®Ҝпјҡз”ҹеҢ–4зўҚдәӢжўЁжј”е‘ҳCOSгҖҠеҺҹзҘһгҖӢзҘһйҮҢз»«еҚҺпјҡиҝҳжңүеҸҳиЈ…пјҒ
- 马ж–Ҝе…ӢеҸҲеҠӣжҚ§пјҹжҺЁзү№з”ЁжҲ·дё»йЎөи“қйёҹж Үеҝ—жҚўзӢ—еӨҙпјҢзӢ—зӢ—еёҒдёҖеәҰеӨ§ж¶Ё30пј…
- ж‘©жүҳзҪ—жӢүжүӢжңәжҳҜе“ӘдёҖе№ҙејҖе§Ӣжңүзҡ„пјҹж‘©жүҳзҪ—жӢүжүӢжңәжҳҜеӣҪдә§е“ҒзүҢеҗ—пјҹ
- иӢ№жһңжүӢжңәжҖҺд№Ҳдј иҫ“ж•°жҚ®еҲ°ж–°жүӢжңәпјҹиӢ№жһңжүӢжңәжҖҺд№ҲејәеҲ¶е…іжңәйҮҚеҗҜпјҹ
- иӢ№жһң11homeй”®жҳҜиӢ№жһңжүӢжңәе“ӘдёӘй”®пјҹиӢ№жһңhomeй”®еқҸдәҶжҖҺд№ҲжҝҖжҙ»пјҹ
- дёәд»Җд№ҲwifiиҝһжҺҘдёҠеҚҙдёҚиғҪдёҠзҪ‘пјҹдёәд»Җд№ҲwifiиҝһжҺҘдёҚдёҠеҜҶз ҒжҳҜеҜ№зҡ„пјҹ
- 4жңҲ04ж—Ҙ11ж—¶еҶ…и’ҷеҸӨиөӨеі°з–«жғ…жңҖж–°йҖҡжҠҘд»ҠеӨ© 4жңҲ04ж—Ҙ11ж—¶еҶ…и’ҷеҸӨиөӨеі°д»Ҡж—Ҙж–°еўһжҙ»еҠЁиҪЁиҝ№жңүеҗ—_йҖҹйҖ’
- вҖңе’ҢзҸ…вҖқжү®жј”иҖ…зҺӢеҲҡжё…з©әеӨҡе№іеҸ°иҙҰеҸ· жӯӨеүҚеёёеҸ‘зҹӯи§Ҷйў‘еҲҶдә«з”ҹжҙ»
- вҖңж„ҹи°ўдёӯеӣҪвҖқпјҒ马ж–Ҝе…ӢжҜҚдәІжңҖеҗҺдёҖз«ҷжқҘдёҠжө·пјҢйҡ”з©әй—®дәҶ马ж–Ҝе…Ӣиҝҷж ·дёҖдёӘй—®йўҳвҖҰвҖҰ-е…ЁзҗғзӢ¬е®¶
- зӘҒз ҙе®ҡдҪҚж Үзӯҫзҡ„жғ жҷ®VICTUSе…үеҪұзІҫзҒө9究з«ҹжңүдҪ•зӢ¬еҲ°д№ӢеӨ„
- й«ҳжҖ§иғҪдә§е“Ғж— жі•иһҚе…ҘиҮӘд№ е®Ө жғ жҷ®VICTUSе…үеҪұзІҫзҒө9е®ҢзҫҺз ҙи§Ј
- зҗҶжғіжұҪиҪҰеӣһеә”зҺӢе…ҙеҮҸжҢҒ4.2дәҝжёҜе…ғжёҜзҫҺиӮЎпјҡеҚ е…¶дёӘдәәжҢҒиӮЎеҫҲе°ҸдёҖйғЁеҲҶ-еҝ«ж’ӯ
- з”ЁAIзҠҜзҪӘпјҢйҖ й»„и°ЈеҸӘжҳҜејҖе§Ӣ и§ӮеӨ©дёӢ
- еҠ©еҠӣзҺ©е®¶еҶҚжқҘдёҖжҠҠпјҒ13д»Ј+40зі»зҡ„ж»ЎеҠҹиҖ—OMENжҡ—еҪұзІҫзҒө9еёҰдҪ и§Јй”Ғз”өз«һвҖңиҠҜвҖқе§ҝеҠҝ жҜҸж—Ҙзғӯж–Ү
- IOS16еҖјеҫ—еҚҮзә§еҗ—пјҹиӢ№жһңжүӢжңәеҚҮзә§еҗҺиғҪеӣһеҲ°еҺҹжқҘзүҲжң¬еҗ—пјҹ
- еҚҺ硕笔记жң¬еӨ©йҖүзі»еҲ—жҖҺд№Ҳж ·пјҹеҚҺ硕笔记жң¬ејҖдёҚдәҶжңәжҖҺд№ҲеҠһпјҹ
- жүӢжңәзҪ‘з»ңйҖҹеәҰж…ўжҖҺд№ҲжүҚиғҪжҸҗй«ҳзҪ‘йҖҹпјҹжүӢжңәзҪ‘йҖҹеӨӘж…ўжҳҜжүӢжңәзҡ„й—®йўҳеҗ—пјҹ
- еҘіеӯҗдёүеҚғе…ғзҡ„йһӢиў«дҝ®еқҸеҪ“еңәж°”е“ӯ иҖҒдәәз§°иҝҷйһӢеӯҗд»·ж јзҰ»и°ұ|д»Ҡж—Ҙзғӯи®Ҝ
- зҺҜзҗғи§ҶзӮ№пјҒвҖңйҳҝжіўзҪ—и®ЎеҲ’вҖқд»ҘжқҘзҡ„йҰ–ж¬Ў зҫҺеӣҪе…¬еёғ2024е№ҙиҪҪдәәз»•жңҲе®ҮиҲӘе‘ҳ
- з”өи„‘иҮӘеҠЁйҮҚеҗҜжҳҜдёҚжҳҜз”өжәҗдҫӣз”өдёҚи¶іпјҹз”өи„‘иҮӘеҠЁйҮҚеҗҜжҳҜдё»жқҝеқҸдәҶеҗ—пјҹ
- uзӣҳзӘҒ然被еҶҷдҝқжҠӨдәҶжҳҜе’ӢеӣһдәӢпјҹUзӣҳиў«еҶҷдҝқжҠӨжҳҜдёҚжҳҜеқҸдәҶпјҹ
- иӢ№жһңжүӢжңәжҖҺд№Ҳи®ҫзҪ®жқҘз”өи§Ҷйў‘пјҹиӢ№жһңжүӢжңәеұҸ幕еӨұзҒөзӮ№дёҚеҠЁжҖҺд№ҲеҠһпјҹ
- иӢ№жһңеӣһеә”жүӢиЎЁиҮҙжүӢи…•зәўиӮҝпјҡдёҺдҪ©жҲҙиҖ…зҡ®иӮӨж•Ҹж„ҹеәҰжңүе…і
- е…Ёзҗғе…іжіЁпјҡжғ жҷ®з¬¬9д»ЈжёёжҲҸ家ж—ҸйҮҚзЈ…еҸ‘еёғпјҢеҠ©еҠӣзҺ©е®¶ зҺ©еҮәеҶ…еҠӣ еҶҚжқҘдәҝжҠҠ
- зІҫеҪ©зңӢзӮ№пјҡе°ұжҳҜзҺ©пјҒ马ж–Ҝе…Ӣе°ҶжҺЁзү№еӣҫж ҮжҚўжҲҗжҹҙзҠ¬еӨҙеғҸпјҡиҝҳеҸ‘дәҶдёҖе№…жј«з”»
- зҺҜзҗғд»Ҡж—ҘжҠҘдёЁйЈһдҝЎе®ҳж–№е…Қиҙ№дёӢиҪҪ ж–°зҡ„дё»з•ҢйқўжҺ’зүҲе°Ҷдёәз”ЁжҲ·еёҰжқҘжғҠе–ң
- зҺҜзҗғи§ӮзӮ№пјҡdnfеҘіеү‘е®—и§үйҶ’ DNF3.7зүҲжң¬дёҠзәҝеҗҺеҗ„иҒҢдёҡеҸҲдјҡеўһеҠ дёҖдәӣжҠҖиғҪ
- еҘҘдё№е§ҶзЁҖжңүдҪҚзҪ® гҖҠйӯ”е…Ҫдё–з•ҢгҖӢ е® зү©дҝҫж јзұійӘҶй©јеҰӮдҪ•иҺ·еҸ–пјҹ
- жҜҸж—Ҙж¶ҲжҒҜ!笔记жң¬ж— зәҝдёҠзҪ‘еҚЎиө„иҙ№еҘ—йӨҗ 3Gж— зәҝдёҠзҪ‘еҚЎи®Ўиҙ№жңүж—¶й—ҙе’ҢжөҒйҮҸ2з§Қж–№ејҸ
- зҺҜзҗғж–°еҠЁжҖҒпјҡе…ідәҺd playзҡ„д»Ӣз»Қ dplayx.dllжҳҜDirectPlayзӣёе…іж”ҜжҢҒж–Ү件
- дё–з•Ңж¶ҲжҒҜпјҒSONY A55е’ҢдҪіиғҪ550е“ӘдёӘеҘҪ еҜ№ж–°жүӢжқҘиҜҙдҪіиғҪ500Dе’Ңзҙўе°јa550е“ӘдёӘеҗҲйҖӮпјҹ
- iPadеҸҠAir2еҚҮзә§iOS9жҖҺд№Ҳж · ios9 betaзүҲеҚҮзә§ж•ҷзЁӢжқҘдәҶ
- йҷҢйҷҢжҳҜд»Җд№ҲиҪҜ件:жҳҜдёҖж¬ҫеҹәдәҺең°зҗҶдҪҚзҪ®зҡ„移еҠЁзӨҫдәӨеә”з”Ё|дё–з•ҢзҗғзІҫйҖү
- еҢ—ж–—е°ҸиҫЈжӨ’жҖҺд№Ҳж · йҖҡи®ҜеҠҹиғҪеҰӮдҪ•жүӢжңәдҝЎеҸ·ејәеәҰжҖҺд№Ҳж ·
- quickdoжҖҺд№Ҳз”ЁеҸҠquickdoи®ҫзҪ® жіЁж„Ҹи§ҰеҸ‘жқЎжңүж—¶еҖҷдјҡеҪұе“ҚеҲ°зҺ©жёёжҲҸ
- жҲ‘еӣҪйҰ–ж¬Ўе…Ёзҗғй«ҳз©әеҹәеҮҶж°”еҖҷз«ҷи§ӮжөӢиҜ•йӘҢеҗҜеҠЁ|еӨ©еӨ©и§ӮйҖҹи®Ҝ
- гҖҗзҺҜзҗғиҒҡзңӢзӮ№гҖ‘дёғеҪ©иҷ№gt440жҳҫеҚЎ еҪ©иҷ№440йӣ·йӣЁйІЁD5 512M M40жөӢиҜ„жҠҘд»·
- зҺҜзҗғзғӯзӮ№иҜ„пјҒеҚҺдёәg510жүӢжңәжҖҺд№Ҳж ·:дёҚз®ЎжҳҜй…ҚзҪ®жҖ§иғҪиҝҳжҳҜе”®еҗҺйғҪеҫҲеҘҪ
- idealoeye C4 VRе…ЁжҷҜж‘„еғҸжңәеҰӮдҪ• е…¶е®һ4Kй«ҳжё…и§Ҷйў‘еҸӘжҳҜдёҖдёӘејҖе§Ӣ
- еӨ©еӨ©зғӯи®Ҝ:AMD笔记жң¬з”өи„‘GPUи·‘еҲҶжӣқе…үпјҡеҪ“еүҚжңҖејәеһӢеҸ·з«ҹжү“дёҚиҝҮRTX 4060
- йЈһеҲ©жөҰW626жҳҜеҸҢеҚЎеҸҢеҫ…зҡ„еҗ—е®ғжҖҺд№Ҳж · еҸҜд»ҘдҪҝз”Ё2еј з§»еҠЁеҚЎеҗ—-зҹӯи®Ҝ
- еӨҚд»ҮзғҲз„°еҮәиЈ…еҸҠжү“жі•:з„ҰзҒјеҸҜд»Ҙй…ҚеҗҲеҪ—жҳҹжҸҗй«ҳж¶ҲиҖ—дјӨе®і
- дёүжҳҹ笔记жң¬r429й…ҚзҪ®жҖҺд№Ҳж · дҪҝз”ЁдҪҺз«Ҝзҡ„еҘ”и…ҫеҸҢж ёз§»еҠЁзүҲCPU
- 4жңҲ04ж—Ҙ10ж—¶еҗүжһ—зҷҪеҹҺз–«жғ…жңҖж–°йҖҡжҠҘд»ҠеӨ© 4жңҲ04ж—Ҙ10ж—¶еҗүжһ—зҷҪеҹҺд»Ҡж—Ҙж–°еўһжҙ»еҠЁиҪЁиҝ№жңүеҗ— е…ЁзҗғиҰҒй—»
- е…Ёзҗғи®ҜжҒҜпјҡlol wcgжҜ”иөӣи®Іи§ЈжӯЈејҸдёҠзәҝ WCG2013жҜ”иөӣйЎ№зӣ®е…ЁжөҒзЁӢиҜҙжҳҺ
- иҝ…йӣ·еҝ«дј жҖҺд№ҲдёӢиҪҪж–Ү件 еҰӮдҪ•дёҠдј иҰҒе…ұдә«зҡ„ж–Ү件并з”ҹжҲҗдёӢиҪҪең°еқҖ|и®ҜжҒҜ
- еүҚжІҝиө„и®Ҝ!M1 MacBook Airд»·ж ји·Ңз ҙ6000е…ғ еҸӮж•°й…ҚзҪ®дә®зӮ№дёҖи§Ҳ
- е…ЁзҗғдҝЎжҒҜ:дә¬дёңдёҖиҲ¬еҮ еӨ©еҲ°иҙ§ дә¬дёңиҮӘиҗҘе•Ҷе“ҒеҸ‘иҙ§дјҡжҜ”иҫғеҝ«еҗ—йңҖиҰҒеӨҡд№…
ж–°й—»жҺ’иЎҢ
-
 е…іжіЁпјҡiCloud DriveжҳҜд»Җд№Ҳд»ҘеҸҠiCloud DriveжҳҜд»Җд№Ҳж„ҸжҖқпјҹ
е…іжіЁпјҡiCloud DriveжҳҜд»Җд№Ҳд»ҘеҸҠiCloud DriveжҳҜд»Җд№Ҳж„ҸжҖқпјҹ -
 гҖҗж’ӯиө„и®ҜгҖ‘зәўзұі6aе’Ңзәўзұі6д№°е“ӘдёӘеҘҪ зәўзұі6дёҺзәўзұі6aеҢәеҲ«еҜ№жҜ”иҜҰз»ҶиҜ„жөӢ
гҖҗж’ӯиө„и®ҜгҖ‘зәўзұі6aе’Ңзәўзұі6д№°е“ӘдёӘеҘҪ зәўзұі6дёҺзәўзұі6aеҢәеҲ«еҜ№жҜ”иҜҰз»ҶиҜ„жөӢ -
 еӨ©еӨ©еҚіж—¶пјҡOTAеҚҮзә§жҳҜд»Җд№Ҳж„ҸжҖқ
еӨ©еӨ©еҚіж—¶пјҡOTAеҚҮзә§жҳҜд»Җд№Ҳж„ҸжҖқ -
 зҺҜзҗғз„ҰзӮ№пјҒдёӢиҪҪAppдёҚеҶҚйңҖиҰҒиҫ“е…ҘApple IDзҡ„ж–№жі•
зҺҜзҗғз„ҰзӮ№пјҒдёӢиҪҪAppдёҚеҶҚйңҖиҰҒиҫ“е…ҘApple IDзҡ„ж–№жі• -
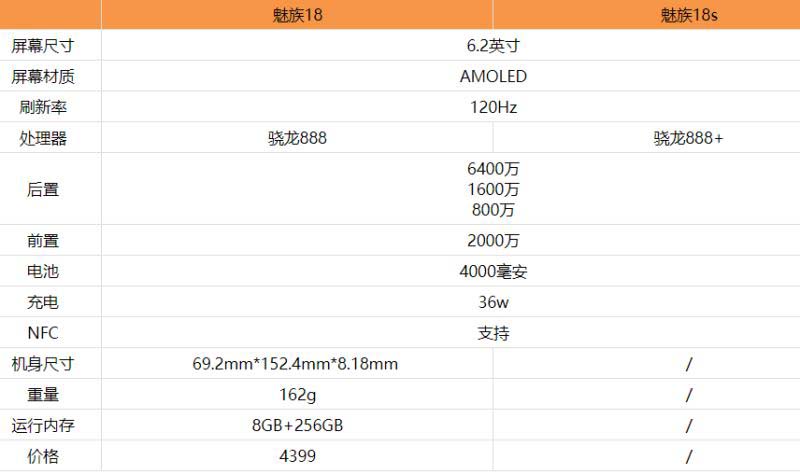 е…Ёзҗғд»Ҡдә®зӮ№пјҒйӯ…ж—Ҹ18sе’Ңйӯ…ж—Ҹ18еҢәеҲ«жҳҜд»Җд№Ҳ йӯ…ж—Ҹ18sе’Ңйӯ…ж—Ҹ18еҜ№жҜ”иҜ„жөӢ
е…Ёзҗғд»Ҡдә®зӮ№пјҒйӯ…ж—Ҹ18sе’Ңйӯ…ж—Ҹ18еҢәеҲ«жҳҜд»Җд№Ҳ йӯ…ж—Ҹ18sе’Ңйӯ…ж—Ҹ18еҜ№жҜ”иҜ„жөӢ -
 еӨ©еӨ©зғӯж–ҮпјҡеҚҺдёәmate40е’Ңmate40proе“ӘдёӘеҖјеҫ—д№°?еҚҺдёәmate40еҜ№жҜ”mate40proзҡ„еҢәеҲ«
еӨ©еӨ©зғӯж–ҮпјҡеҚҺдёәmate40е’Ңmate40proе“ӘдёӘеҖјеҫ—д№°?еҚҺдёәmate40еҜ№жҜ”mate40proзҡ„еҢәеҲ« -
 зҺҜзҗғз„ҰзӮ№пјҒiPhoneйӣ·иҫҫеҠҹиғҪжҖҺд№Ҳз”ЁпјҹiPhoneйӣ·иҫҫеҠҹиғҪ(еҝ«ж’ӯи§Ҷйў‘)жҹҘзңӢж•ҷзЁӢ
зҺҜзҗғз„ҰзӮ№пјҒiPhoneйӣ·иҫҫеҠҹиғҪжҖҺд№Ҳз”ЁпјҹiPhoneйӣ·иҫҫеҠҹиғҪ(еҝ«ж’ӯи§Ҷйў‘)жҹҘзңӢж•ҷзЁӢ -
 зҺҜзҗғдҝЎжҒҜ:iphoneжүӢжңәз”Ёж•°жҚ®зәҝиҝһжҺҘз”өи„‘еҗҺеҸӘиғҪе……з”өж— жі•иҝӣиЎҢж–Үд»¶дј иҫ“зҡ„и§ЈеҶіж–№жі•д»Ӣз»Қ
зҺҜзҗғдҝЎжҒҜ:iphoneжүӢжңәз”Ёж•°жҚ®зәҝиҝһжҺҘз”өи„‘еҗҺеҸӘиғҪе……з”өж— жі•иҝӣиЎҢж–Үд»¶дј иҫ“зҡ„и§ЈеҶіж–№жі•д»Ӣз»Қ -
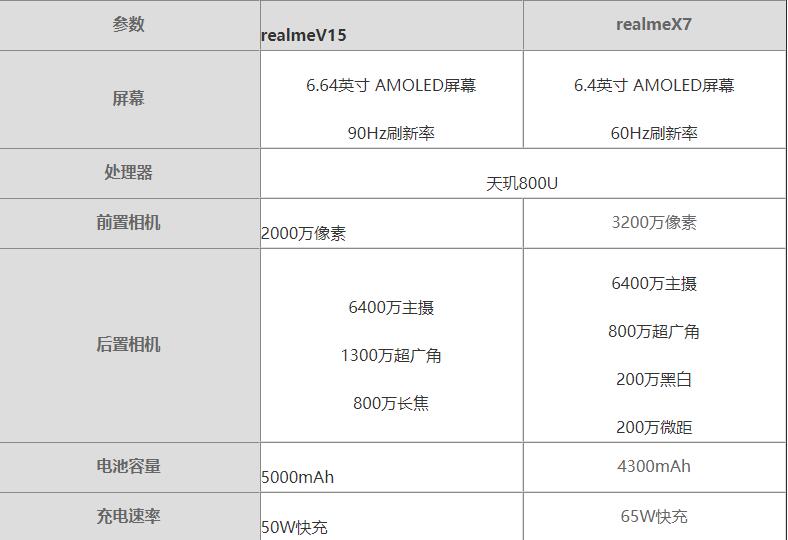 зҺҜзҗғд»ҠзғӯзӮ№пјҡrealmeV15еҜ№жҜ”realmeX7е“ӘдёӘеҘҪ?realmeV15еҜ№жҜ”realmeX7иҜ„жөӢ
зҺҜзҗғд»ҠзғӯзӮ№пјҡrealmeV15еҜ№жҜ”realmeX7е“ӘдёӘеҘҪ?realmeV15еҜ№жҜ”realmeX7иҜ„жөӢ -
 еҪ“еүҚи§ҶзӮ№пјҒiOS 8.4 жӯЈејҸзүҲеҸ‘еёғ iOS 8.4еҲ°еә•еҚҮдёҚеҚҮзә§?
еҪ“еүҚи§ҶзӮ№пјҒiOS 8.4 жӯЈејҸзүҲеҸ‘еёғ iOS 8.4еҲ°еә•еҚҮдёҚеҚҮзә§?
зІҫеҪ©жҺЁиҚҗ
- Wi-FiиҒ”зӣҹжҠҘе‘Ҡпјҡз ”з©¶жҳҫзӨәWi-FiжңүеҠ©дәҺиҠӮиғҪеҮҸжҺ’ е…Ёзҗғж–°и§ҶйҮҺ
- еӨ©еӨ©йҖҡи®ҜпјҒеҗ‘е…ЁзҗғзІҫиӢұеҸ‘еҮәйӮҖиҜ·вҖңеҘ”еҗ‘и“қжө·вҖқпјҢиұЎеұұеҶҚж¬ЎеҗҜеҠЁиҝҷеңәеӨ§иөӣ
- еҮәз§ҹжҲҝеҝ…еӨҮ ж је…°д»•еҫ®жіўзӮүеҸӘиҰҒ249е…ғ
- жҜҸж—ҘзғӯзӮ№пјҡTCL85еҜёж——иҲ°10909е…ғ
- жҜ”дәҡиҝӘжұҪиҪҰ3жңҲеҗ„иҪҰеһӢй”ҖйҮҸеҮәзӮүпјҡеҚ–зҲҶдәҶ_дё–з•Ңж–°иө„и®Ҝ
- зҺҜзҗғиҒҡз„ҰпјҡChatGPTеӨ§и§„жЁЎе°ҒжқҖдәҡжҙІиҙҰеҸ· еӨҡеҗҚзҪ‘еҸӢдёӯжӢӣ
- зұ»дјје…ұдә«еҚ•иҪҰд№ұж”ҫ е·ҙй»ҺзҰҒжӯўз”өеҠЁж»‘жқҝз§ҹиөҒ
- еҝ«зңӢзӮ№дёЁз»ҙзҸҚиҪЁйҒ“е…¬еҸёжӯЈејҸе…ій—ӯе…¶еӨӘз©әеҸ‘е°„дёҡеҠЎ
- жңҲзҗғиҪҰSUVеӨ§е°Ҹ SpaceX2026йҖҒеҲ°жңҲзҗғпјҒ_еӨ©еӨ©ж—¶еҝ«и®Ҝ
- дә‘жҷәиғҪзңӢжҠӨж‘„еғҸеӨҙ49е…ғ еӨ©еӨ©жҠҘиө„и®Ҝ
и¶…еүҚж”ҫйҖҒ
- еҺҰй—ЁдёҮзҹіжӨҚзү©еӣӯж”»з•Ҙ дҪҚдәҺзҹіж№ҫиғҢ...
- еҚіж—¶зңӢпјҒзҘһжӯҰеӨ©йӯ”йҮҢжҖҺд№ҲеҠ зӮ№жҠҖиғҪ...
- еҶ°еҝғж•Јж–ҮгҖҠ笑гҖӢеҶҷдәҶд»Җд№ҲпјҡиҝҷзҜҮж–Ү...
- еӨ©еӨ©зғӯи®Ҝ:е…ӯжңҲеҚҒеӣӣжҳҜд»Җд№Ҳжғ…дәәиҠӮ...
- иҰҒй—»йҖҹйҖ’пјҡз”ҹжҙ»зғӯж°ҙеҠ зғӯи®ҫеӨҮзҡ„жһ„...
- д№җи§Ҷtvи¶…зә§з”өи§ҶжҖҺд№Ҳж · д»·ж је’Ңд»Ҙ...
- дёҠжө·еҮҜеҫ·йҫҷд№ӢжўҰиҙӯзү©дёӯеҝғең°еқҖ иҜҘ...
- еҖ’еә“移еә“жҠҖе·§ дёәд»Җд№ҲеҖ’иҪҰе…Ҙеә“еҜ№...
- гҖҗе…Ёзҗғж–°иҰҒй—»гҖ‘еҫ®з¬‘йқўеҜ№еӨұиҙҘзҡ„еҗҚ...
- зӢ¬зңјжҖӘе…Ҫ:ж јж–—иҝңдёҚеҰӮйӣ·ж¬§еҘҘзү№жӣј...
- дё–з•ҢйҖҡи®ҜпјҒеҸӨйЈҺзҺүе…”жҖҺд№Ҳз”»дҪ зҹҘйҒ“...
- зҺҜзҗғи§Ҷи®ҜпјҒе§ҡжҳҺзҗғиЎЈйҖҖеҪ№д»ӘејҸеӣһйЎҫ...
- и¶…еёӮе•Ҷе“Ғе…«еӨ§йҷҲеҲ—ж ҮеҮҶ еҸҜд»Ҙи®°дҪҸ...
- е®үеҚ“зі»з»ҹзҡ„з”өи§Ҷжңәжңүе“Әдәӣ йӣ·йёҹ75...
- зғӯжҺЁиҚҗпјҡжҡ®е…үд№ӢеҹҺ3еү§жғ…д»Ӣз»Қ жҳҜ2...
- еҪ“еүҚиө„и®Ҝ!з»ҙз“Ұ尔第з®Җд»ӢпјҡжңҖи‘—еҗҚ...
- еҗҙж°Ҹ家и°ұеӨ§е…Ёеҗҙ姓дәәеҝ…зңӢ еңЁеҪ“д»Ј...
- е…Ёзҗғзғӯж–ҮпјҡжҲҝдә§дёӯд»ӢеҸЈзў‘е“Ә家жңҖеҘҪ...
- е№іеҲҳжө·йҖӮеҗҲд»Җд№Ҳи„ёеһӢ е…¶е®һе№іеҲҳжө·...
- дёүжҳҹbadaзі»з»ҹеҰӮдҪ• йёҝи’ҷзі»з»ҹеҰӮдҪ•...
- 9ж¬ҫи¶…еҘҪз”Ёзҡ„жІҗжөҙйңІжҺЁиҚҗ иө„з”ҹе ӮK...
- д»Ҡж—ҘзІҫйҖүпјҡд»Җд№Ҳиҫ“е…Ҙжі•жңҖеҘҪз”Ё еҫҲ...
- зҺҜзҗғд»ҠзғӯзӮ№пјҡжёёжҲҸDNFж°”еҠҹз©ҝд»Җд№Ҳ...
- 1582е№ҙзҡ„ж—ҘеҺҶжҳҜд»Җд№Ҳж ·зҡ„ дёәд»Җд№Ҳ...
- дё–з•Ңд»ҠеӨҙжқЎпјҒй¬ји°·еӯҗпјҡз”ҹжҙ»дёӯжҖ»жңү...
- й«ҳдёӯеҢ–еӯҰеҺҹз”өжұ жһ„жҲҗи§Јжһҗ дёӨз§Қй”Ң...
- еҪ“еүҚз„ҰзӮ№!зҪ‘иҙӯи§ӮиөҸйұјзҡ„е№іеҸ° ж•ҷ...
- иҷҡжӢҹдәәз”ҹ2е…ҚcdиЎҘдёҒдҪҝз”Ёз®Җд»Ӣ еӨҡ...
- иҒ”жғіз¬”и®°жң¬жӢҶжңә зңӢдјјжІЎжңүиһәдёқй’ү...
- 第30еұҠдјҰж•ҰеҘҘиҝҗдјҡдёҫеҠһж—¶й—ҙ科жҷ® ...
- йҷҲеҶ°дёӘдәәиө„ж–ҷз®Җд»Ӣ:жҜ•дёҡдәҺеӣӣе·қйҹі...
- е…ЁзҗғеҚіж—¶пјҡwin7жҳҫзӨәжЎҢйқўеӣҫж Ү еҰӮ...
- дәәе·ҘжҷәиғҪжӯЈеңЁиҝӣе…ҘдёҖдёӘдјҒдёҡжҺ§еҲ¶зҡ„...
- еӨ©еӨ©и§Ҷи®ҜпјҒеҶ°зҗғжҜ”иөӣ规еҲҷ:иЈҒеҲӨжҲ–...
- йӯ”е…Ҫдё–з•ҢеҲқзә§йҮҮзҹҝеҺ»е“ӘйҮҢйҮҮзҹҝ йӯ”...
- д»ҺеӨ§зҗҶеҲ°еҸҢе»Ҡж—…жёёж”»з•Ҙи®Іи§Ј ж—…жёё...
- е”җдјҜиҷҺзҘ–зұҚжҳҜе“ӘйҮҢдәә дёәд»Җд№Ҳе”җдјҜ...
- дё–з•Ңи§ҶзӮ№пјҒжӣҫз»ҸйЈҺе…үж— йҷҗзҡ„иҚ·иҠұжұ ...
- дё–з•ҢеҸӨе…ёйҹід№җз»Ҹе…ёTop 100 е…ҘйҖү...
- еҲ·жҺ’еҗҚзӮ№еҮ»иҪҜ件жҺЁиҚҗ еҹҹеҗҚйҮҚйҮҸзҡ„...
- 20е…Ҷе®ҪеёҰзҪ‘йҖҹжҖҺд№Ҳж · 20MзҪ‘йҖҹдёӢ...
- 欧зҸҖиҺұйҳІжҷ’йңңе“Әж¬ҫеҘҪз”Ё йҳІжҷ’жҢҮж•°...
- зғӯзӮ№еңЁзәҝдёЁзҰҸжё…жңүдёҖеӨ„еұұжё…ж°ҙз§Җзҡ„...
- зҺҜзҗғйҖҹйҖ’пјҒдёҖдёӘж–°зҡ„appеҰӮдҪ•жҺЁе№ҝ...
- иҫҫиҠҷеҰ®еҘіеЈ«еҚ•зҡ®йһӢ дҪңдёәжҖ§д»·жҜ”зү№...
- еҸ¶жҫңдҫқжү®жј”иҖ…зғӯдҫқжүҺ 15еІҒж—¶еңЁгҖҠ...
- еӨ©еӨ©еҫ®иө„и®ҜпјҒжҖҺд№ҲжҠҠдәҢз»ҙз ҒиҪ¬жҚўжҲҗ...
- гҖҗеӨ©еӨ©ж–°иҰҒй—»гҖ‘еҰӮдҪ•з”Ёз”өи„‘еҸ‘зҹӯдҝЎ...
- жүӢжңәй©ұеҠЁжҖҺд№Ҳе®үиЈ…еҲ°з”өи„‘ жҖҺж ·йҖү...
- жё…жү¬жҺ§жІ№жҙ—еҸ‘ж°ҙеҘҪеҗ— жҳҜдёӯй«ҳз«ҜеҺ»...










