化学平衡知识点总结 期末必考知识 如何解决化学平衡移动问题的思维模式 环球观热点
提起化学平衡知识点(化学平衡知识点总结,期末必考知识!) 大家在熟悉不过了,被越来越多的人所熟知,那你知道化学平衡知识点(化学平衡知识点总结,期末必考知识!) 吗?快和小编一起去了解一下吧!
化学平衡知识点(化学平衡知识点总结,期末必学知识!)
 (资料图)
(资料图)
今天,小编为同学们准备了一份化学平衡相关知识点的总结。快来收藏吧!
1、化学平衡的运动
1.化学平衡的变化
(1)定义
达到平衡态的反应体系,条件改变,导致平衡态被破坏。
(2)化学平衡运动的过程
2.影响化学平衡移动的因素
(1)温度:在其他条件不变的情况下,温度升高,化学平衡会向吸热反应移动;当温度降低时,化学平衡向放热反应方向移动。
(2)浓度:在其他条件不变的情况下,提高反应物浓度或降低产物浓度,化学平衡向正反应方向移动;当反应物浓度降低或产物浓度增加时,化学平衡向相反的反应方向移动。
(3)压力:对于反应前后总体积发生变化的化学反应,在其他条件不变的情况下,增加压力,化学平衡会向气体体积减少的方向移动;当压力降低时,化学平衡向气体体积增加的方向移动。
(4)催化剂:由于催化剂可以同时提高或降低正反应速率和逆反应速率,所以对化学平衡的移动没有影响。
3.勒查特莱原则
在封闭系统中,如果一个条件(如温度、压力或浓度等。)影响化学平衡被改变时,平衡会向能减弱这种改变的方向移动。
2.外部条件对化学平衡移动的影响
1.外界条件对速度的影响及平衡运动方向的判断。
在一定条件下,浓度、压力、温度、催化剂等外界因素。会影响可逆反应的速率,但平衡不一定移动。只有v为正≠v为负,均衡才会移动。
3.如何解决化学平衡图像问题?
化学图像测试是高考中的一个热门话题。这类测试经常涉及的图像类型有物质资源量(丰富资源)、速率-时间图像、含量-时间-温度(压力)图像、恒温恒压曲线等。图像信息丰富,简洁、直观、生动,命题形式灵活,难度不大。解决问题的关键是根据反应特点。这类题在选择题和简答题中都有涉及,能很好的考察学生分析问题和解决问题的能力,在复习备考中要引起足够的重视。
2.化学平衡图像解原理
(1)解决问题的思路
(2)解决问题的步骤
4.顺差
1.意义
(1)化学平衡的状态与建立平衡的条件有关,而与建立平衡的方式无关。
(2)对于同一个可逆优优资源 *** 反应,在一定条件下(恒温、定容或定压),无论是从正反应(反应物)、逆反应(产物)还是中间态(反应物和产物都有),只要建立平衡,平衡混合物中各组分的比例相同,或者混合物中各组分的百分比相等。这种化学平衡称为主动平衡。
(3)注意只有组分的百分比相同,包括物质的体积百分比、数量百分比或质量百分比,但各组分的浓度不一定相等。
2.考试方法
(1)注意反应特性:反应前后气体物质的量是否有变化。
(2)区分建立平衡的条件:恒温、恒压或定容。
5.解决化学平衡移动问题的思维模式。
6.构造一个“虚拟第三平衡”的方法来解决平衡之间的关系。
解题时,如果条件变化后难以比较新平衡与旧平衡的关系,可以考虑构造一个与旧平衡等价的“虚拟第三平衡”,然后通过压缩或扩大体积的方式与新平衡沟通,形成有利于解题的新模型,促进条件向结论的转化,例如:
(1)构建等温等容平衡的思维模式:新的平衡态可以认为是两个原有平衡态的简单叠加和压缩,相当于增加了压力。
(2)建构等温等压平衡的思维模式(以气态物质的量增加的反应为例(见图):新的平衡态可以看作是两个原平衡态的简单叠加,压强不变,平衡不变。
\- 环球观天下!win7系统玩dnf时一直卡在选择角色界面 大家只要参考下文教程内容操作即可
- 电脑总是出现IE浏览器已停止工作的提示 大家可以参考本文提供的方法
- 怎么进行磁盘清理 磁盘清理有什么用 其实清理磁盘的方法有很多
- 全球热头条丨关联词语的分类及用法8种关系 新手必会的关联词语用法大全收集
- 昂达mp3维修常见故障及解决办法 为什么会出现不开机的故障
- 惠普笔记本如何通过自带工具进行HP电池检查 注意电池充放电异常会影响其使用寿命
- 应用程序无法正常启动错误代码c0000005 可选择兼容模式运行这个程序
- 音响线怎么接电脑主机 有需要的朋友可以通过这步骤进行操作
- 世界快资讯:win7登录魔兽世界提示blz51900012错误 小编收集整理出具体的解决方法给大家
- 微头条丨Win7经常出现“Windows正在下载更新”提示 只需要更新这个部分即可
- 上大学买什么笔记本好 提示:大学使用电脑主要考虑实用性
- 天天精选!哪个u盘pe支持大于4g的iso系统:可以改用这个工具制作
- 今日热闻!windows7旗舰版激活密钥 小编跟大家整理分享密钥激活码
- 电脑无法登录QQ提示连接服务器超时错误码的方法 希望能解答各位小伙伴的疑惑
- tcl a906怎么样?好不好?tcla906手机的详细评测上线
- 播报:三星s7572怎么样:是一款高品质的智能手机 外观出色
- 当前消息!双核平板电脑哪款好:苹果iPad Pro是一款屏幕为12.9英寸的大屏双核平板电脑
- win7按关机没反应怎么回事 快和小编一起去了解一下吧
- 监听耳机是什么 监听耳机类型 本文为你介绍相关知识
- 最新Nvidia/AMD显卡性能排行榜 两大品牌同时排名方便查看
- 全球通讯!win7斜箭头符号怎么打出来 今天小编告诉大家一个小技巧
- 环球今热点:windows7系统qq打不开的解决方法 不妨直接参考这个教程解决吧
- win7系统玩帝国时代2出现花屏怎么办 想进一步了解的用户不妨往下看
- 焦点要闻:WinXP系统怎么卸载PHPnow 这样设置之后PHPnow就卸载成功了
- 【天天时快讯】Win7系统如何打开图种 打开图种的方法:我们一起来学习下吧
- 世界热讯:windows 10 正式版64位/32位下载 跟大家分享免费的windows 10 正式版
- 高手教你怎么安装和使用usb无线网卡 今天教程告诉大家怎么安装和使用usb无线网卡 环球通讯
- 热消息:Win7屏蔽TenioDL.exe等 可以用开机命令的方法一下解决
- 世界信息:魅族 20系列发布24小时首冠战报出炉:霸榜京东、抖音等六大平台!
- 当前观点:性能稳了!曝三星Galaxy S24系列存储将从256GB起步,内存从8GB提升至12GB
- 马斯克74岁母亲来武汉游玩:频繁晒照 称中国悠久的历史令人着迷
- 【全球速看料】官翻版iPad mini 6开售:便宜不少
- 建议友商跟进!深蓝汽车豪送大礼:已提车用户享终身整车质保 当前热门
- E宝发布白嫖整活视频 预热下周喜加一《消逝的光芒》_当前播报
- 环球讯息:4月01日14时山西吕梁今天疫情最新消息 4月01日14时山西吕梁最新疫情情况
- 环球视讯!4月01日13时四川乐山最新疫情防控信息 4月01日13时四川乐山今天出多少阳性
- 玩家推测《星空》没有大气层飞行 采用老派加载方式
- 顽皮狗再次就《最后生还者:第一部》优化致歉:承诺恢复游戏质量
- 4月01日12时辽宁葫芦岛今天疫情最新消息 4月01日12时辽宁葫芦岛最新疫情情况
- 苹果MR头显无码组件曝光
- PS日本推出图书主题手柄箱 庆祝日本大学开学季|世界动态
- 【手慢无】炸裂性能!联想笔记本电脑低至5649元
- 【手慢无】直降601元!惠普光影精灵9价格有点狠
- iPhone15 Pro颠覆了17年的设计
- iPhone大面积bug:苹果自带天气崩了 无任何数据
- 环球快看点丨苹果天气小组件现大范围bug:无任何数据
- 【手慢无】立减300元!戴尔轻薄办公游戏笔记本电脑折后3669元 全球热点
- 双卫网_双卫网登录入口|焦点速看
- 《星际宝贝》真人电影主演敲定!小萝莉形象很是还原
- 播报:B站上线愚人节彩蛋:大会员变“小会员” “冷搜榜”上线
- 4月01日11时湖北荆州疫情防控情况 4月01日11时湖北荆州疫情最新通知
- vivo X Flod2发布时间曝光 搭载高刷大屏+索尼IMX866主摄 环球热点评
- 领导微信群多次辱骂同事致其自残抑郁 被判道歉赔偿:你在职场被PUA了吗
- 世界微速讯:媒体人借《塞尔达传说:王国之泪》锐评主流3A:过分追求画面 忽视游戏机制
- iPhone15Pro固态按键灵敏度可调:方便戴手套操作|天天微头条
- 4月01日10时贵州六盘水今天疫情最新消息 4月01日10时贵州六盘水最新疫情情况 全球快看
- 广东人成为全国最“潮”的仔 衣服晾一星期没干:雨要继续下 今年最大范围雨雪来袭|环球观点
- 全球今日报丨武术散打挑战赛在海南白沙黎族自治县文体中心开打
- 最新消息:验证码拦不住机器人了!谷歌AI已能精准识别模糊文字,GPT-4则装瞎求人帮忙
- 报告称 Galaxy S23 推动三星成为智能手机市场的头把交椅 今日热议
- 《吸血鬼幸存者》4.13推出新DLC:森林新图新角色!-焦点消息
- 今日4月01日09时云南大理疫情新增病例名单 4月01日09时云南大理最新疫情通报|环球速看料
- 当前焦点!加满一箱油少花13元!油价迎今年来最大降幅
- 保留3.5mm耳机插口!曝realme Narzo N55手机预计4月12日发布|全球快看点
- 【全球新视野】不虚标!比亚迪汉EV冠军版实测光电续航达成率93.1%
- 苹果6月6日召开WWDC23:神秘MR头显或发布-精彩看点
- 天天微速讯:散热无敌了!真我GT Neo5 SE配4500mm2超大钢化VC、13颗传感器
- 理想L系累计交付超10万台:跻身豪华车前五名-热推荐
- 能领百万优惠券 罗永浩卖淘宝直播卖卫星 观焦点
- 环球即时:4月01日08时广东东莞疫情最新消息 4月01日08时广东东莞今日确诊人数
- 腾讯QQ Linux 3.1.1版发布:支持国产CPU和操作系统 速递
- 4月01日08时四川甘孜疫情最新消息 4月01日08时四川甘孜今日确诊人数
- 罗永浩在淘宝直播间卖民用卫星:最低200万即可拥有
- 孩子被家暴法律要怎么判刑_环球观察
- Windows 11 2024版发布了 可免费下载_今日热闻
- 5999元买RTX4060配置 3月最热卖游戏本竟然是它 附游戏体验实测
- 一个强大的太阳耀斑引起地球部分区域无线电通信停摆一小时
- 【手慢无】价格低于双十一!雷神911Air玄武5游戏本再降500元
- 4月01日07时辽宁葫芦岛今天疫情最新消息 4月01日07时辽宁葫芦岛最新疫情情况-环球热议
- 大商股份(600694)2022年年报财务简析:净利润减27.69%,债务压力大
- 【环球播资讯】4月01日06时山东德州今天疫情最新消息 4月01日06时山东德州最新疫情情况
- 罗永浩直播带货最贵的商品卖出:原价200万的卫星100万成交
- 热点!内存/SSD白菜价甩卖 美光芯片大减产:工厂停机率创纪录
- 【手慢无】戴尔也绷不住了!15.6寸灵越笔记本便宜170元
- 三星以未来将3D NAND为目标打造PB级固态硬盘 新技术预计2030年后发布
- 【手慢无】这块16寸4K OLED大屏爱了!小米Book Pro直降870元_当前滚动
- 全球快消息!全球首个商用海底数据中心在海南下水:算力高、散热不费电
- 当前视讯!汉唐元三车齐发!比亚迪乘用车在西班牙正式开售
- 储殷:舒适在体会前是一种奢侈 体会后是一种必需_世界观速讯
- 女子在千万网红直播间买芒果吃出蛆:孩子吃了肚子疼
- 全球快资讯:等待时间太长 英国对苹果手机浏览器限制的调查被终止
- 西藏药业: 西藏诺迪康药业股份有限公司2022年年度股东大会决议公告
- 股票行情快报:中路B股(900915)3月31日主力资金净卖出1.31万元
- 3月31日23时西藏拉萨疫情防控情况 3月31日23时西藏拉萨疫情最新通知
- 世界热讯:3月31日23时山西临汾今天新增确诊名单 3月31日23时山西临汾疫情防控政策最新通知
- 金豆子理财买1克亏100!专家:想获益简直天方夜谭 快看
- 世界今热点:只是裁员还不够!Meta计划降薪同时重启绩效考评
- 《生化危机4:重制版》官方公告:第12章有严重BUG 正在修复中
- 动漫美图杂赏:薄纱、短裙 圆润火爆的AI美少女带来春日双倍美好 天天热头条
- 3月31日22时云南昆明有确诊病例吗 3月31日22时云南昆明疫情实时最新通报
新闻排行
-
 关注:iCloud Drive是什么以及iCloud Drive是什么意思?
关注:iCloud Drive是什么以及iCloud Drive是什么意思? -
 【播资讯】红米6a和红米6买哪个好 红米6与红米6a区别对比详细评测
【播资讯】红米6a和红米6买哪个好 红米6与红米6a区别对比详细评测 -
 天天即时:OTA升级是什么意思
天天即时:OTA升级是什么意思 -
 环球焦点!下载App不再需要输入Apple ID的方法
环球焦点!下载App不再需要输入Apple ID的方法 -
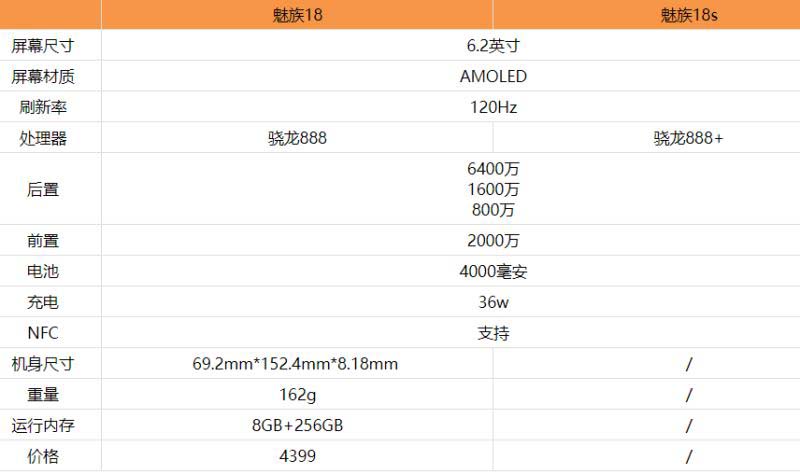 全球今亮点!魅族18s和魅族18区别是什么 魅族18s和魅族18对比评测
全球今亮点!魅族18s和魅族18区别是什么 魅族18s和魅族18对比评测 -
 天天热文:华为mate40和mate40pro哪个值得买?华为mate40对比mate40pro的区别
天天热文:华为mate40和mate40pro哪个值得买?华为mate40对比mate40pro的区别 -
 环球焦点!iPhone雷达功能怎么用?iPhone雷达功能(快播视频)查看教程
环球焦点!iPhone雷达功能怎么用?iPhone雷达功能(快播视频)查看教程 -
 环球信息:iphone手机用数据线连接电脑后只能充电无法进行文件传输的解决方法介绍
环球信息:iphone手机用数据线连接电脑后只能充电无法进行文件传输的解决方法介绍 -
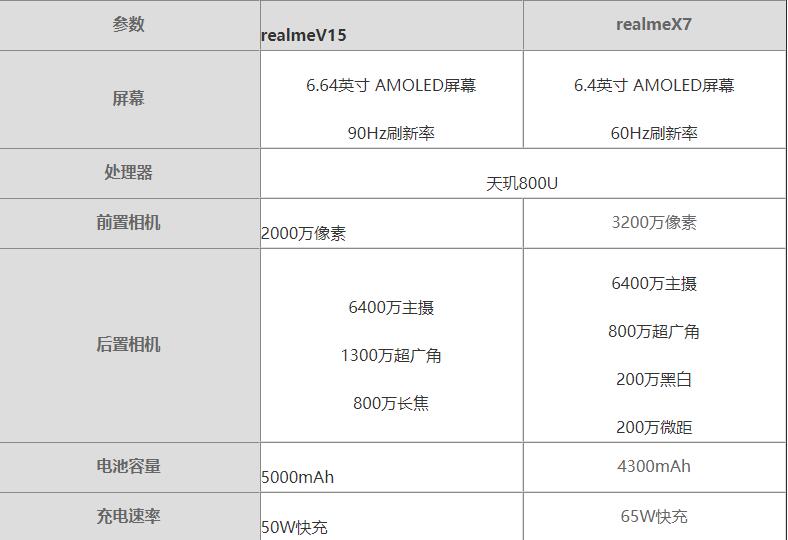 环球今热点:realmeV15对比realmeX7哪个好?realmeV15对比realmeX7评测
环球今热点:realmeV15对比realmeX7哪个好?realmeV15对比realmeX7评测 -
 当前视点!iOS 8.4 正式版发布 iOS 8.4到底升不升级?
当前视点!iOS 8.4 正式版发布 iOS 8.4到底升不升级?
精彩推荐
超前放送
- 闪卡识字与“闪卡”学习法 英文...
- 乡土散文我的美丽乡愁是谁写的 ...
- 化学平衡知识点总结 期末必考知...
- 微速讯:打开方式怎么还原你知道...
- 游民晨播报:Xbox版《师父》实体...
- 焦点简讯:外媒投票:是否会购买...
- 4月HB慈善包爆料:《死亡搁浅:...
- 最好的三星 Galaxy S23 颜色...
- 当前速讯:《最后生还者:第一部...
- xt788摩托罗拉评测 报价及刷机...
- ChatGPT对手 Bard将大幅度升级
- 被称韩国版的《甄嬛传》是哪部 ...
- 佳能hfr306的最新报价 佳能HF ...
- 格兰仕微波炉维修网点有哪些 可...
- 倩女幽魂方士技能加点 炼丹师是...
- 小米平板6高配版搭载骁龙8+处理...
- 每日速看!安卓手机可以简易共享...
- 春风对什么 可以写春风的对联的...
- 如何进入加密qq空间 本文将讲解...
- 4月03日08时四川自贡疫情防控情...
- 回南天除湿机12L只要479元 环球观点
- 怎么看期指持仓 股票中的期货是...
- 身价计算方式 快来看看你“值多...
- nds勇者斗恶龙4攻略 火焰纹章系...
- 观热点:三星e120参数介绍 支持...
- 电脑复制粘贴快捷键是什么 其实...
- 点钞机是什么:全智能型点钞机功...
- 女子乘车遇大叔车顶有一窝蜜蜂:...
- 原子核裂变原理:是指一个重核分...
- 等不及了!有玩家拼出了《王国之...
- 世界观天下!s5570三星多少钱?...
- 世界热头条丨【手慢无】捡便宜了...
- 电脑编程入门 电脑编程入门自学...
- 暮光之城有几部电影 《暮光之城...
- 新款超充来了?特斯拉中国宣布4...
- 男子贪吃春笋后呕血又昏厥:这5...
- 599美元香吗?RTX4070价格泄露-今日报
- 观察:默认网关怎么设置 路由器...
- 当前滚动:iGotYa怎么设置 需要...
- 跟我走吧天亮就出发什么歌名 希...
- 马斯克认证服务遭受重挫 美国多...
- 四人搬木头打一字求答案 这句话...
- 浙江文旅观察:露营真的成“过去...
- 跳房子游戏规则:必须一次按顺序...
- 当前视点!北京爱情故事插曲有哪...
- 【手慢无】性能突出!联想笔记本...
- 研究证实普通化肥化合物可将促成...
- 国语配音上译经典电影:剧本翻译...
- 孙悦与富豪老公罕秀恩爱 这位歌...
- 热文:霍地琼斯的真面目 其为日...










